
2022年4月12日,病原生物學研究所郭斐團隊在Science Signaling發表了題為“SARS-CoV-2 spike protein–induced cell fusion activates the cGAS-STING pathway and the interferon response”的文章,闡述SARS-CoV-2 virus誘導的細胞-細胞融合對于I型干擾素應答的影響,被選為當期雜志封面,并入選當期science雜志的“Research highlight”。
SARS-CoV-2病毒感染導致了新冠相關疾病(COVID-19)世界范圍的大流行,重癥COVID-19常伴隨大量的炎癥因子產生和嚴重的肺損傷。I型干擾素(IFN)系統在其中發揮重要作用,一方面對抗病毒免疫至關重要,另一方面也可能導致過度炎癥和免疫病理。已有研究發現在重癥COVID-19患者肺部存在大量融合的肺泡細胞。此外,在SARS-CoV-2感染的動物肺部和細胞模型中,均觀察到細胞-細胞融合的現象,提示SARS-CoV-2誘導的細胞-細胞融合可能在病毒感染誘導的免疫應答中發揮作用,但具體機制尚不清楚。
本研究團隊首先利用表達SARS-CoV-2 Spike(S)蛋白的供體細胞與A549-ACE2靶細胞共培養誘導細胞-細胞融合,模擬SARS-CoV-2病毒感染誘導多胞體形成的過程。利用RNA測序技術分析融合細胞與不表達受體ACE2或不表達S蛋白的非融合細胞基因表達差異,發現分別有73或79個基因上調,對上調基因進行聚類分析發現,主要集中在抗病毒應答、干擾素應答、細胞因子應答通路,提示多核體細胞中天然免疫應答通路活化。在分析不同多核體細胞的基因表達差異時,發現HEK293T-ACE2形成的多核體細胞中IFN通路沒有活化。已有研究發現在HEK293T細胞中cGAS-STING通路缺失,推測是否cGAS-STING通路在多核體細胞產生IFN中發揮作用。通過基因敲除和過表達cGAS/STING,證實cGAS分子通過感知融合細胞中釋放的微核,產生2’3’-cGAMP激活STING,進而促進I型干擾素應答(如圖)。與VSV病毒感染相比,VSV-SARS-CoV-2-S病毒感染誘導細胞形成多核體,并產生核損傷,釋放微核,促使cGAS識別細胞質中的微核,促進IFN產生。
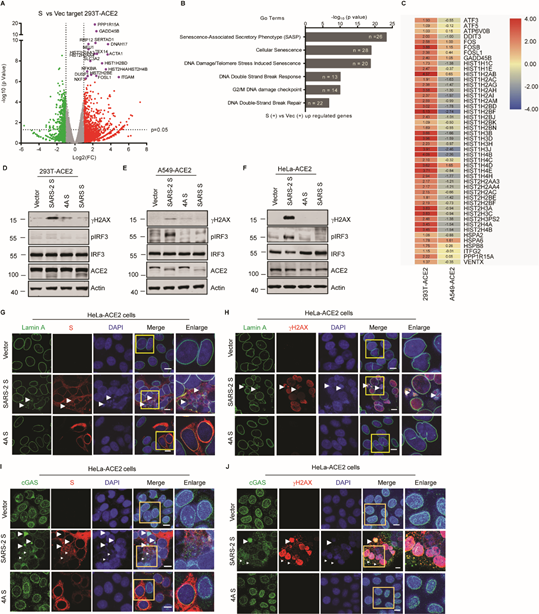
圖. 表達S蛋白的融合細胞發生核損傷,并釋放微核被cGAS分子識別
由于此類I型IFN應答是感染細胞中大量合成的S蛋白與相鄰細胞表面的ACE2受體結合誘發細胞-細胞融合,進而導致核損傷釋放的微核被cGAS識別導致的,發生于SARS-CoV-2感染晚期。不同于病毒感染早期,進入的病毒基因組RNA被TLR3、MDA5和RIG-I等模式識別受體識別所誘導產生的IFN,病毒感染晚期產生的IFN被認為加劇了炎癥反應和病理損傷。這也與Domizio等(Nature 2022)和Neufeldt 等(Commun Biol, 2022)分別在近期發表的兩篇研究結果一致,提示SARS-CoV-2感染導致cGAS-STING激活是COVID-19中病理性I型IFN反應的主要驅動因素。該研究發現S蛋白誘導的細胞-細胞融合激活cGAS-STING通路促進I型IFN反應,推測其加重COVID19免疫病理,提示蛋白酶抑制劑、中和抗體和小分子藥物可能通過靶向抑制細胞融合在重癥保護中發揮作用。
該研究得到國家自然科學基金(82072288)、國家重點研發計劃(2020YFA0707600,2018YFE0107600,2016YFD0500307))和中國醫學科學院醫學與健康科技創新工程(2018-I2M-3-004,2021-I2M-1-038)等項目的支持。中國醫學科學院病原生物學研究所郭斐研究員、加拿大麥吉爾大學梁臣教授和中國醫學科學院生物技術研究所岑山教授為論文共同通訊作者。中國醫學科學院病原生物學研究所博士后劉曉滿、碩士研究生魏亮為論文共同第一作者。
論文鏈接:https://www.science.org/doi/10.1126/scisignal.abg8744