
2020年5月25日,Nature Chemistry在線發表中國醫學科學院藥物研究所天然藥物活性物質與功能國家重點實驗室、北京大學化學與分子工程學院以及中國中醫科學院中藥資源中心合作完成的題為FAD-dependent Enzyme-catalysed Intermolecular [4+2] Cycloaddition in Natural Product Biosynthesis 的研究論文,報道了自然界中首例催化分子間[4+2]環加成反應、單功能Diels-Alderase(環化酶)。
Diels-Alder反應是一種共軛二烯體和親二烯體之間的協同[4+2]環加成反應,為有機合成化學中選擇性構筑碳-碳鍵及復雜碳環的重要方法之一。Diels-Alder反應存在于眾多天然產物生物合成過程中,造就了天然產物結構及生物活性的多樣性,相關Diels-Alderase一直引起科學家的高度關注。目前報道的Diels-Alderase多為催化分子內Diels-Alder反應、多功能酶,且多來源于微生物,而來源于植物、催化分子間Diels-Alder反應的單功能Diels-Alderase尚無報道。植物源天然產物生物合成相關基因往往不成簇,已報道的Diels-Alderase多分屬不同酶家族、無系統進化上的相關性,發現困難。
該研究基于酶活性的蛋白分離純化、蛋白質組及轉錄組學、生物合成中間體探針 (biosynthetic intermediate probe)等多技術相結合,從桑培養細胞中發現并鑒定了一FAD依賴的單加氧酶MaDA,能高效、嚴格立體選擇性地催化分子間[4+2]環加成反應形成典型的環己烯結構單元,且對二烯體及親二烯體均具較寬的底物譜;同時鑒定了另一FAD依賴的單加氧酶MaMO能催化異戊烯基氧化形成二烯體,二者共同完成了桑中chalcomoracin等異戊烯黃酮類Diels-Alder加合物生物合成關鍵反應(圖1)。密度泛函理論計算(DFT)及動力學同位素效應(KIE)實驗顯示該反應為協同、非同步的周環反應,結構生物學結合定點突變闡明了[4+2]環加成反應過程中底物與酶之間相互作用的分子機理。MaDA為自然界中首例催化分子間[4+2]、單功能Diels-Alderase,它的發現不僅揭示了桑中Diels-Alder加合物生物合成途徑中關鍵反應的酶學機制,而且為天然產物生物合成未知關鍵酶的發現提供了借鑒,同時還為結構多樣藥用天然產物高效立體選擇性酶化學法合成提供了強有力工具。
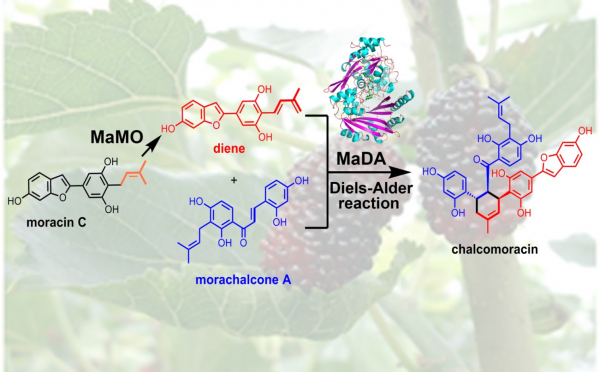
圖1. MaDA高效立體選擇性催化[4+2]環加成反應生成DA加合物Chalcomarocin
中國醫學科學院藥物研究所天然藥物活性物質與功能國家重點實驗室戴均貴研究員、北京大學化學與分子工程學院雷曉光教授以及中國中醫科學院中藥資源中心黃璐琦研究員為該文的共同通訊作者;雷曉光和戴均貴課題組聯合培養博士生高磊、戴均貴課題組博士生蘇聰、雷曉光課題組博士后杜曉霞和中國中醫科學院助理研究員王瑞杉為該文的并列第一作者。美國加州大學洛杉磯分校K.N. Houk教授、北京生命研究所黃牛及陳涉教授、日本北海道大學H. Oikawa教授及帝京平成大學M. Shimazaki教授研究組參與了該項研究。該工作得到了國家重大專項“重大新藥創制”、國家自然科學基金委、國家重點研發計劃、中國醫學科學院醫學與健康科技創新工程(項目編號:2016-I2M-3-012)、名貴中藥資源可持續利用能力建設項目等基金的資助。
論文鏈接:https://www.nature.com/articles/s41557-020-0467-7
藥物研究所