
2021年3月24日,中國醫學科學院醫藥生物技術研究所、藥物研究所等合作單位在Science Translational Medicine封面發表了“Faciogenital Dysplasia 5 supports cancer stem cell traits in basal-like breast cancer by enhancing EGFR stability”的論文。研究報道了FGD5(Rho鳥苷酸交換因子家族成員,Faciogenital Dysplasia 5)通過加強EGFR(表皮生長因子受體,Epidermal growth factor receptor)的蛋白穩定性維持基底樣乳腺癌(Basal like breast cancer, BLBC)的干細胞樣性狀,從而促進BLBC的發病、疾病進展和治療抵抗。
大多數基底樣乳腺癌(BLBC)是三陰性乳腺癌(TNBC),而TNBC由于復發率高且缺乏針對性治療方法,預后較其他乳腺癌亞型差。之前的研究表明,EGFR信號通路在TNBC細胞中異常活化,雖然敲除EGFR能抑制TNBC細胞生長及其侵襲特性,但EGFR靶向抑制劑(吉非替尼、拉帕替尼)在TNBC患者中的臨床治療效果并不理想;而EGFR的表達上調與其基因拷貝數增加無直接關聯,提示EGFR的高表達可能與其蛋白降解調節異常相關,因此探究EGFR的穩定性調控機制具有較好的研究前景和重要的研究意義。早期研究表明,FGD5可能是乳腺癌新的預后指標,提示其可能與乳腺癌發病及進展存在密切聯系。
我們的研究團隊發現FGD5在BLBC組織樣本中高表達,且與其不良預后呈正相關。敲除FGD5可抑制BLBC細胞的干細胞樣性狀、侵襲能力及增殖活性,同時增加化療藥物的敏感性。使用三轉基因小鼠模型(Fgd5K14;loxpWnt),進一步發現乳腺上皮特異性敲除Fgd5降低BLBC小鼠模型腫瘤發生率,延長該模型小鼠生存周期(圖1),且降低乳腺上皮干細胞的數量和功能。以上結果表明FGD5通過維持腫瘤起始細胞(TICs)的數量以及成瘤能力從而參與BLBC發病和疾病進程。基于以上研究,我們的團隊進一步發現BLBC中高表達的FGD5通過與EGFR相互作用并抑制EGFR的泛素化降解,從而促進BLBC細胞增殖活性、侵襲能力和自我更新能力。
之后我們的研究團隊篩選到一種可以破壞FGD5-EGFR相互作用的先導物多肽PER3。在動物實驗中,先導物多肽PER3顯示出比常規化療更好地抑制BLBC疾病進展的藥效活性。本項研究顯示,先導物通過阻斷FGD5與EGFR相互作用來降低EGFR的蛋白穩定性,具有較好的抑制BLBC發生和發展的成藥前景。
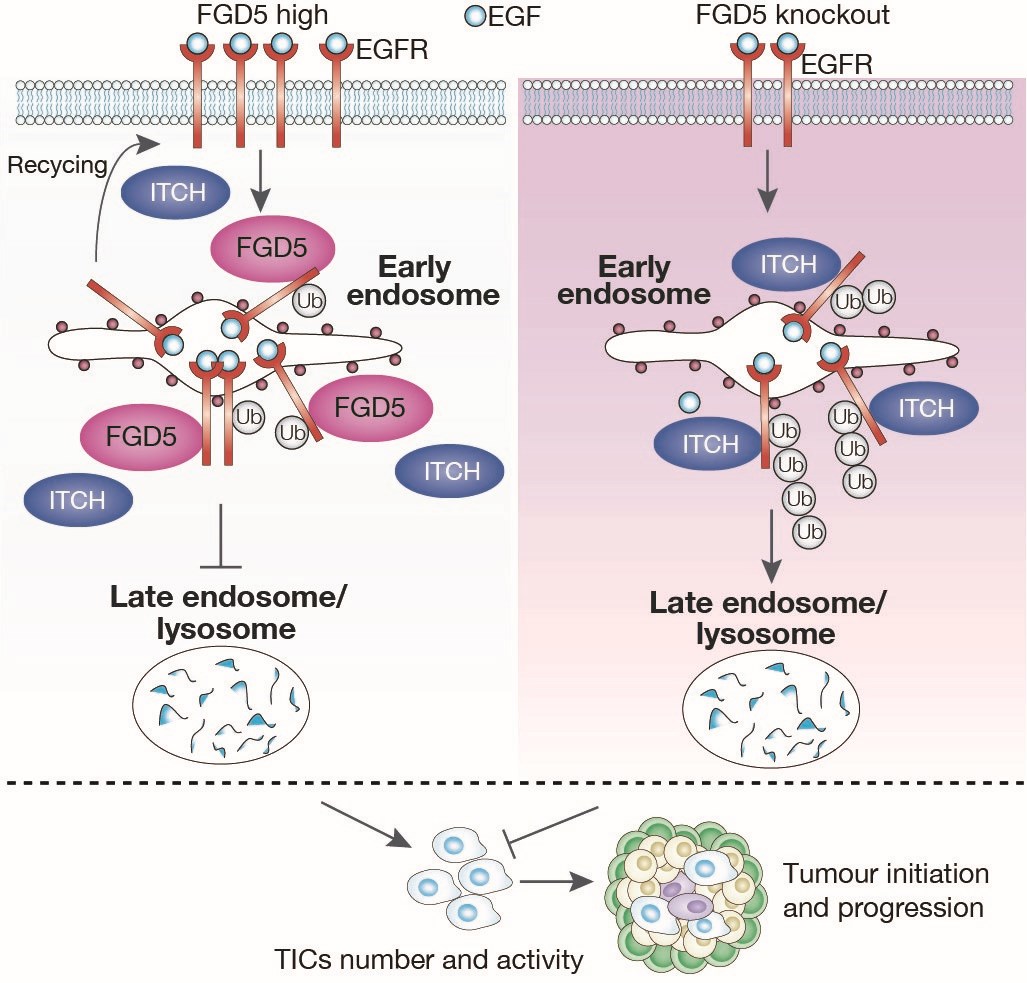
圖1. A model of the mechanism of FGD5 in BLBC cells with or without FGD5 deletion.
本項研究不但首次證明FGD5是維持腫瘤起始細胞活性的關鍵分子,提示其可以作為BLBC亞型乳腺癌的潛在治療靶點;而且提示進一步研發靶向阻斷FGD5與EGFR二者相互作用的先導物多肽可以為基底樣乳腺癌(BLBC)的治療提供新策略。
本研究工作得到中國醫學科學院醫學與健康科技創新工程(2016-I2M-1-007;2016-I2M-1-011;2016-I2M-3-008)等項目的資助。中國醫學科學院胡卓偉研究員、李珂副研究員和花芳研究員為論文共同通訊作者,李珂副研究員、博士研究生張婷婷和碩士研究生趙晨曦為論文的共同第一作者。
論文鏈接:https://stm.sciencemag.org/content/13/586/eabb2914