
由新型冠狀病毒(SARS-CoV-2)感染引起的新冠肺炎(COVID-19)的感染人數和死亡人數還在持續攀升,對全球經濟和公共衛生帶來前所未有的挑戰,目前尚無特效的抗新冠病毒藥物,新藥物、新靶點的研發勢在必行。除病毒自身靶點之外,尋找有效的宿主靶點逐漸成為藥物研發的新趨勢。冠狀病毒不但編碼結構蛋白和非結構蛋白,還具有一套獨特的“輔助蛋白”。輔助蛋白并非病毒復制必須的蛋白質,但它們對冠狀病毒在細胞中的生存至關重要。輔助蛋白參與天然免疫的調節,促進病毒感染。SARS-CoV-2感染的特征之一是IFN-I的誘導被抑制,這歸功于輔助蛋白對IFN-I信號通路的干擾。有證據表明:SARS-CoV-2輔助蛋白Orf9b能夠與錨定在線粒體膜的多功能接頭蛋白TOM70結合,從而抑制抗病毒天然免疫反應。
病原生物學研究所崔勝團隊于2021年5月14日在Nature Communications上發表題為《Crystal Structure of SARS-CoV-2 Orf9b in Complex with Human TOM70 Suggests Unusual Virus-Host Interactions》的論文。依賴X射線晶體衍射技術,SARS-CoV-2 Orf9b/TOM70復合物結構的分辨率大幅提升至2.2?。在高分辨率三維結構的幫助下,研究人員不但更精確地揭示了Orf9b-TOM70相互作用的結構基礎,而且發現,SARS-CoV-2 Orf9b通過占據TOM70 CTD口袋改變NTD的構象,從而別構抑制TOM70 NTD與Hsp90蛋白的結合。這些發現有力支持了Orf9b通過結合TOM70干擾Hsp90-TOM70相互作用,最終抑制IFN-1信號通路的假說。
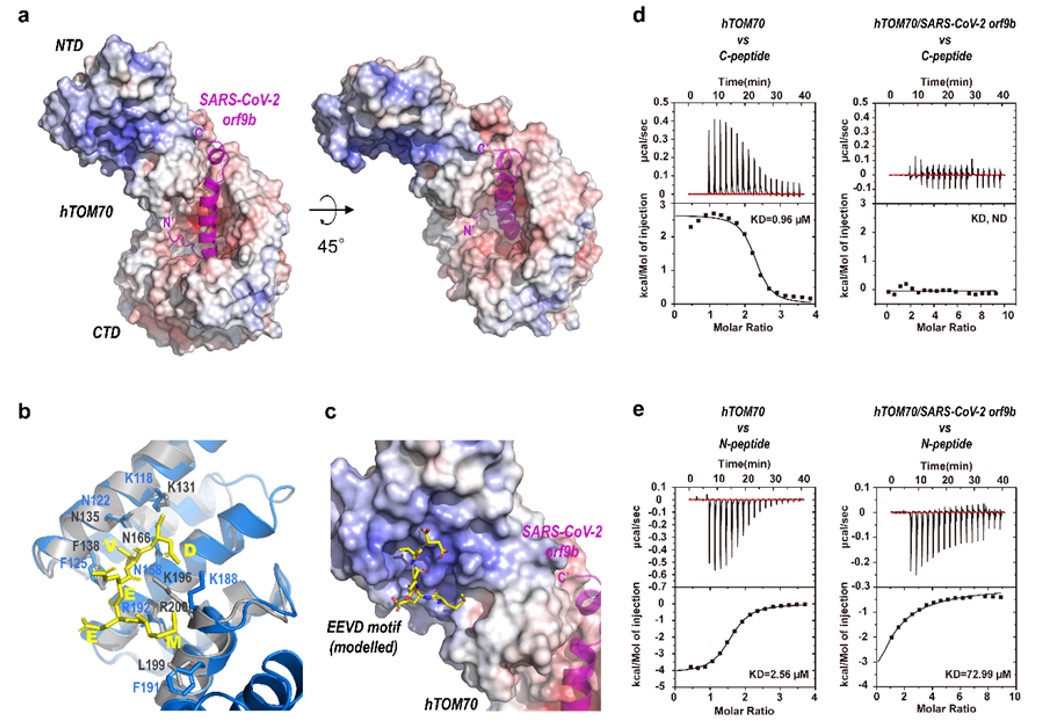
圖:SARS-CoV-2輔助蛋白Orf9b與宿主蛋白TOM70的復合物晶體結構
及Orf9b的別構抑制機制
病原所崔勝研究員為本文的通訊作者,崔勝課題組副研究員高小攀博士、博士生朱凱翔和主管技師秦博為本文的共同第一作者。本研究得到中國醫學科學院醫學與健康科技創新工程(2017-I2M-1-014和2016-I2M-1-013)、國家重點研發專項(2018ZX10101001)等項目的資助。
論文鏈接:https://www.nature.com/articles/s41467-021-23118-8
文圖|病原生物學研究所