
2023年2月2日,中國醫學科學院基礎醫學研究所黃波團隊在Science Translational Medicine《科學轉化醫學》發表題為“Epigenetic modification of CSDE1 locus dictates immune recognition of nascent tumorigenic cells”(CSDE1的表觀遺傳修飾決定了新生腫瘤細胞的免疫識別)的研究論文,詮釋了原始腫瘤細胞逃避免疫攻擊的過程,并從源頭部分解釋人為什么得腫瘤,又如何不得腫瘤背后的機制。
腫瘤發生是基因突變的結果。然而,DNA突變卻是一個正常的生理現象,其在正常人體細胞中高頻出現。DNA突變作為一種隨機事件,在絕大多數情況下,其會導致細胞死亡或不產生顯著影響;但是極少數情況下,DNA突變將導致細胞轉化成為腫瘤細胞。盡管DNA突變導致正常細胞惡性轉化的幾率非常低,但由于機體細胞數量極其巨大,使得機體出現腫瘤細胞成為一個不可避免的結局,并在個體中普遍存在。盡管如此,出現這些腫瘤細胞并不等同于得腫瘤。在人群中,只有極少數個體的腫瘤細胞最終發展成為有臨床癥狀的腫瘤,即我們常說的“得了腫瘤”。那么,同樣是惡性轉化的腫瘤細胞,為什么出現“長腫瘤”亦或“不長腫瘤”的不同結局?這其中一個重要原因是機體存在強大的免疫監視,特別與一類稱之為CD8+ T細胞的關鍵免疫細胞相關,其識別腫瘤細胞表面的腫瘤抗原并進而將腫瘤細胞殺滅。然而,總有少數腫瘤細胞能夠逃避CD8+ T細胞的識別和殺傷,特別是突變所致的腫瘤細胞在最初形成之際,該初始腫瘤細胞面臨免疫監視抑或逃逸監視的選擇,從而決定腫瘤的最終命運,因此,闡明該事件背后的機制是腫瘤免疫研究的核心問題,但卻一直是一個謎團,這主要歸結于缺乏相應的腫瘤模型(一個腫瘤細胞長出一個腫瘤)和手段。
腫瘤種子細胞,亦稱為腫瘤干細胞,是非常少的一群具有自我更新能力的關鍵腫瘤細胞,具有極強的成瘤性,是腫瘤發生的根源。本研究團隊前期利用生物機械力學的原理,建立了軟的三維纖維蛋白凝膠(Soft 3D fibrin gel)培養系統,能夠在體外篩選、擴增腫瘤種子細胞,而在體內接種 5個細胞即可在免疫正常的小鼠體內成瘤。在本研究中,該團隊成功地接種一個腫瘤種子細胞,使其能夠在免疫正常小鼠體內長出腫瘤。利用該手段,團隊發現單個腫瘤種子細胞,盡管在免疫缺陷的小鼠均可成瘤,但在免疫正常的小鼠體內只有一部分成瘤,一部分不成瘤。這表明腫瘤種子細胞成瘤的能力相似,但受免疫識別和監視的特性卻存在差別。研究還發現,這些最終能發展成為腫瘤的種子細胞均高表達一種稱之為CSDE1的RNA結合蛋白。進一步的分子機制探究揭示,原始的腫瘤種子細胞在早期擴增階段,受微環境的生物機械力的作用,出現了表觀遺傳修飾的差異,導致一部分腫瘤種子細胞高表達CSDE1,而另一部分則低表達該蛋白;CSDE1通過穩定一種磷酸水解酶PTPN2的mRNA而上調其表達,PTPN2識別磷酸化的酪氨酸位點,從而使STAT1去磷酸化而失活。活化的STAT1是啟動抗腫瘤免疫的關鍵信號,其能夠使腫瘤細胞高表達腫瘤抗原,促進CD8+ T細胞識別和殺傷。因此,一旦STAT1分子失活,腫瘤種子細胞獲得了腫瘤免疫逃逸的表型,進而逃避免疫攻擊,最終發展成為具有臨床癥狀的腫瘤。
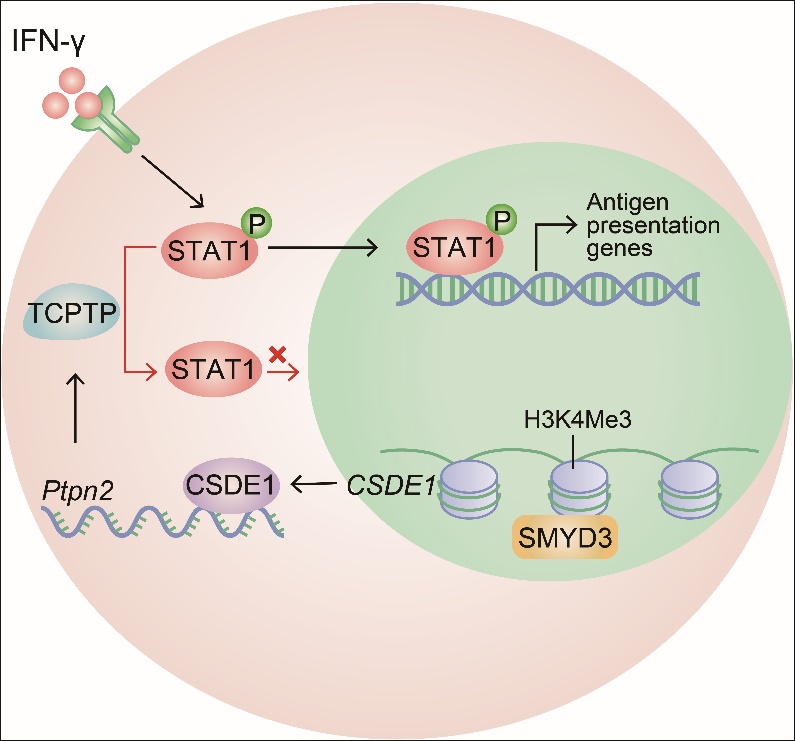
本團隊利用單一腫瘤細胞成瘤模型,模擬腫瘤發生極早期其原始腫瘤細胞與免疫互作過程,揭示出腫瘤免疫逃逸的新機制,為目前臨床腫瘤免疫治療后復發,提供新的理論基礎和研究方法,為發展下一代腫瘤免疫治療提供了潛在策略。
本研究工作得到了國家自然科學基金(81788101)、中國醫學科學院醫學與健康科技創新工程項目(2021-I2M-1-021)等項目的資助。中國醫學科學院基礎醫學研究所黃波教授為通訊作者,助理研究員呂家迪和博士后周雅博為論文的共同第一作者。
論文鏈接:https://www.science.org/doi/10.1126/scitranslmed.abq6024