
北京時間2019年11月26日,中國醫學科學院基礎醫學研究所生物化學與分子生物學系/醫學分子生物學國家重點實驗室劉德培團隊在 Nature Cell Biology雜志上發表了題為“Diurnal oscillations of endogenous H2O2 sustained by p66Shc regulate circadian clocks”的文章,第一次揭示了氧化還原信號在一個近日節律周期(24小時)內的變化規律,找到了氧化還原信號節律和經典生物節律轉錄翻譯負反饋調控機制之間直接耦合的關鍵點,證明了氧化還原信號節律在生物節律中的重要生理作用。

眾所周知,幾乎所有生命活動都具有生物節律振蕩現象,其背后的機制目前存在兩種理論,一種是已經被諾獎認可的基于基因轉錄的轉錄翻譯負反饋環路(TTFL),另一種是機制尚不清楚的基于代謝的氧化還原振蕩子,兩種機制之間是否存在直接聯系已經被業界探索和討論了很長一段時間卻仍懸而未決。
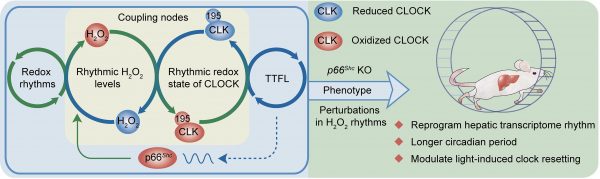
該團隊對單個細胞以及小鼠肝臟內的過氧化氫(H2O2)水平在不同時間點進行測定,發現 H2O2水平呈現近日節律振蕩。研究人員采用巧妙篩選策略,發現核心生物節律調控分子CLOCK蛋白可以直接感受內源性H2O2的振蕩。通過構建點突變小鼠證明半胱氨酸195位點可以直接被內源性H2O2有節律地氧化修飾,而這一修飾對于正常的生物節律不可或缺。該團隊還證明此前該實驗室發現的表觀修飾酶SIRTUIN家族中SIRT1的下游分子p66Shc蛋白是內源性H2O2節律振蕩的關鍵因子,敲除該關鍵因子可以擾亂內源性H2O2節律、破壞CLOCK氧化還原修飾的正常振蕩節律和生物鐘功能,最終導致小鼠肝臟轉錄組振蕩重塑,增加小鼠自由周期時長,影響光照對于小鼠節律行為的重新調定。該研究第一次真正彌合了不依賴于轉錄的氧化還原振蕩節律和依賴于轉錄的轉錄翻譯負反饋環路(TTFL)機制兩大學術觀點之間的鴻溝,大大增加了人們對于驅動生物節律振蕩的根本機制的認識。

鑒于該研究工作的意義,瑞士日內瓦大學Ueli Schibler教授在同期Nature Cell Biology雜志上發表評論,高度評價了該工作,認為該工作“事實上幫助核實了在哺乳動物細胞內存在獨立于轉錄翻譯負反饋環路的氧化還原振蕩子”,并認為“即便在缺乏CRY和PER蛋白的情況下,野生型CLOCK和BMAL1也可以有節律地激活下游基因,而CLOCKC195S突變則喪失了這一功能”。(評論鏈接:https://www.nature.com/articles/s41556-019-0430-2)

劉德培課題組2011級直博生裴建飛(右三),2016級直博生李勛凱(左一)和2015級直博生李文琪(左二)為并列第一作者,劉德培院士(左三)和陳厚早教授(右二)為共同通訊作者。
本研究的合作者有原中國醫學科學院基礎醫學研究所生理系曹濟民課題組(現山西醫科大學),北京生命科學研究所張二荃課題組,國家蛋白質科學中心楊靖研究員,以及Scripps研究所的Kate S. Carroll研究員。本研究得到了中國醫學科學院創新工程(CIFMS 2017-I2M-1-008, 2016-I2M-1-015、2016-I2M-1-011)、基本科研業務費(2019-RC-HL-006)、國家自然科學基金(91849207, 81701387, 91639304, 31471126、31571193)、中國醫學科學院醫學表觀遺傳學研究中心(2017PT31035、2018PT31015)、國家博士后科研基金專項資助(2017T100051)和青年人才獎勵項目的資助。
文章鏈接:https://www.nature.com/articles/s41556-019-0420-4
(基礎醫學研究所)