
2022年1月5日,國際權威期刊Science Translational Medicine作為封面文章刊登了中國醫學科學院藥物研究所天然藥物活性物質與功能國家重點實驗室花芳課題組題為 “TRIB3 Reduces CD8+ T Cell Infiltration and Induces Immune Evasion by Repressing the STAT1-CXCL10 Axis in Colorectal Cancer”的研究論文。

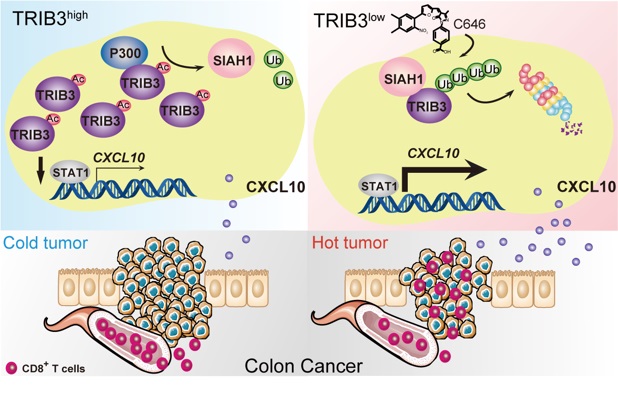
結直腸癌是嚴重威脅人類健康的第三大高發腫瘤,目前以手術切除為主,化放療靶向治療為輔,患者一旦出現耐藥、轉移則使治療陷入困境。免疫療法的興起為結腸癌患者帶來曙光,然而臨床研究發現只有少數微衛星不穩定的患者對免疫治療有響應,占比不足15%。CD8+ T細胞浸潤匱乏是導致結直腸癌患者無法從免疫療法中獲益的重要原因之一,而造成結直腸癌出現“免疫沙漠”的原因仍是未解之謎。花芳研究員長期關注假性激酶蛋白TRIB3的促腫瘤機制研究,既往工作證實,在結腸癌中異常高表達的TRIB3與患者不良預后密切相關,該蛋白通過上調Wnt/-catenin信號通路增強腫瘤干細胞特性,促進結腸癌發生、發展(Gastroenterology,2019)。但TRIB3是否也是造成結直腸癌免疫逃逸的關鍵因素尚不清楚。
本研究證實TRIB3可抑制STAT1的轉錄激活活性,降低趨化因子CXCL-10的表達,最終抑制CD8+ T細胞在腫瘤局部募集,促進結直腸癌免疫逃逸,提示靶向抑制TRIB3是促使“冷腫瘤升溫”的重要策略。研究團隊進一步探究造成TRIB3在結直腸癌中高表達原因的研究發現,乙酰轉移酶P300介導的TRIB3第240位賴氨酸乙酰化修飾是造成TRIB3無法經蛋白酶體降解而異常高表達的關鍵。流行病學研究發現,糖尿病人群罹患結腸癌風險顯著高于普通人群。考慮到高糖微環境是造成蛋白乙酰化修飾活躍的代謝因素,花芳研究員與中國醫學科學院腫瘤醫院張海增主任開展基礎與臨床學科交叉合作。通過對患有糖尿病的結腸癌臨床樣本及糖尿病結腸癌小鼠模型等開展的多層次研究,首次從免疫微環境角度為糖尿病患者結腸癌高發且預后不良的臨床現象提供了全新的機制闡釋。基于基礎研究的發現,研究人員還探索了增敏結直腸癌免疫治療的新策略。利用P300的特異性抑制劑C646降低TRIB3表達可促進CD8+ T細胞在腫瘤局部募集,并顯著增強免疫檢查點抑制劑(PD-L1及PD-1單抗)的腫瘤殺傷作用。該團隊針對TRIB3開展的兩項結腸癌研究提示,靶向TRIB3不僅可降低腫瘤細胞干性特征,更可激活抗腫瘤免疫反應,使結腸癌治療實現“一石二鳥”的效果。這為結直腸癌治療提供了全新的思路和靶點。
相關工作得到了國家重點研發計劃(2017YFA0205400)、中國醫學科學院醫學與健康科技創新工程(2021-I2M-1-021)、北京市卓青計劃(BJJWZYJH01201910023028)以及國家自然科學基金(81973344, 81673474, 81903636)等項目的資助。胡卓偉教授生前對該研究給予了大力支持。藥物研究所助理研究員尚爽及碩士研究生楊雨薇、陳菲為共同第一作者,花芳研究員及醫科院腫瘤醫院張海增主任為共同通訊作者。
論文鏈接:https://www.science.org/doi/10.1126/scitranslmed.abf0992