
流感病毒是威脅人類健康的主要病原體之一,曾引發多次全球大流行,并在每年造成季節性流行。內源性免疫是宿主抵抗病毒感染的第一道防線。現已發現多個宿主蛋白具有抗病毒功能,是抗病毒藥物研發的重要靶標蛋白。MARCH蛋白是一類位于膜上的E3泛素連接酶,已有研究發現其在宿主抗病毒內源性免疫中發揮重要作用,但其抗病毒譜和抗病毒機制并不清楚。
2021年7月20日,郭斐和王健偉課題組在Nature communications上發表了題為MARCH8 inhibits influenza A virus infection by targeting viral M2 protein for ubiquitination-dependent degradation in lysosomes的論文,進一步闡釋了MARCH8作為宿主限制因子抑制甲型流感病毒復制的作用及其分子機制。
作者首先利用慢病毒包裝體系,分析了MARCH8對于流感病毒包膜蛋白功能的影響,發現MARCH8能夠顯著降低病毒M2蛋白在細胞中的表達水平。用病毒感染MARCH8過表達或敲除的細胞系,進一步證實MARCH8能夠降低病毒M2蛋白在細胞中尤其是在細胞質膜上的表達豐度。用PPMO降低小鼠肺臟中的MARCH8蛋白的表達后,發現病毒復制增加,表明MARCH8能夠抑制流感病毒在小鼠體內的復制,其作用機制是通過泛素化病毒M2蛋白,促進質膜上的M2蛋白內吞并經溶酶體途徑降解,降低M2蛋白在質膜上的分布,進而阻斷病毒顆粒的釋放。MARCH8介導底物分子的降解,依賴于底物分子胞內區的賴氨酸殘基。M2蛋白的胞內區含有四個賴氨酸殘基,分別為K49,K56,K60和K78。因此,作者分別對四個賴氨酸殘基進行單個或全部突變,獲得五個M2 K>R突變體。通過比較野生型M2和K>R突變M2被MARCH8泛素化修飾和降解情況,發現病毒M2蛋白的K78位點是MARCH8的主要作用靶點。通過構建攜帶K78R突變的甲型流感病毒毒株,發現突變病毒株在細胞和小鼠體內具有更好的復制能力。進一步分析K78位點在流感病毒中的保守性,作者發現2009甲型H1N1的流行株通過獲得78/79位點非賴氨酸的突變,逃逸MARCH8的抗病毒作用。 該研究闡釋了宿主的內源性免疫作用及病毒的適應性突變機制,為高產流感病毒疫苗株的改造提供了新的理論基礎。
該工作得到了中國醫學科學院醫學與健康科技創新工程(2018-I2M-3-004,2020-I2M-2-014),國家科技重大專項(2018ZX10301408-003和2018ZX10731101-001-018),國家自然科學基金(82072288)等項目的支持。郭斐研究員和王健偉研究員為共同通訊作者,劉曉滿、許豐雯和任麗麗為論文共同第一作者。同時,該研究得到了中國醫學科學院病原生物學研究所趙振東研究員,中國醫學科學院生物醫藥與技術研究所岑山研究員,中國疾病與預防控制中心病毒病研究所宋敬東副研究員,加拿大麥吉爾大學梁臣教授的大力支持。
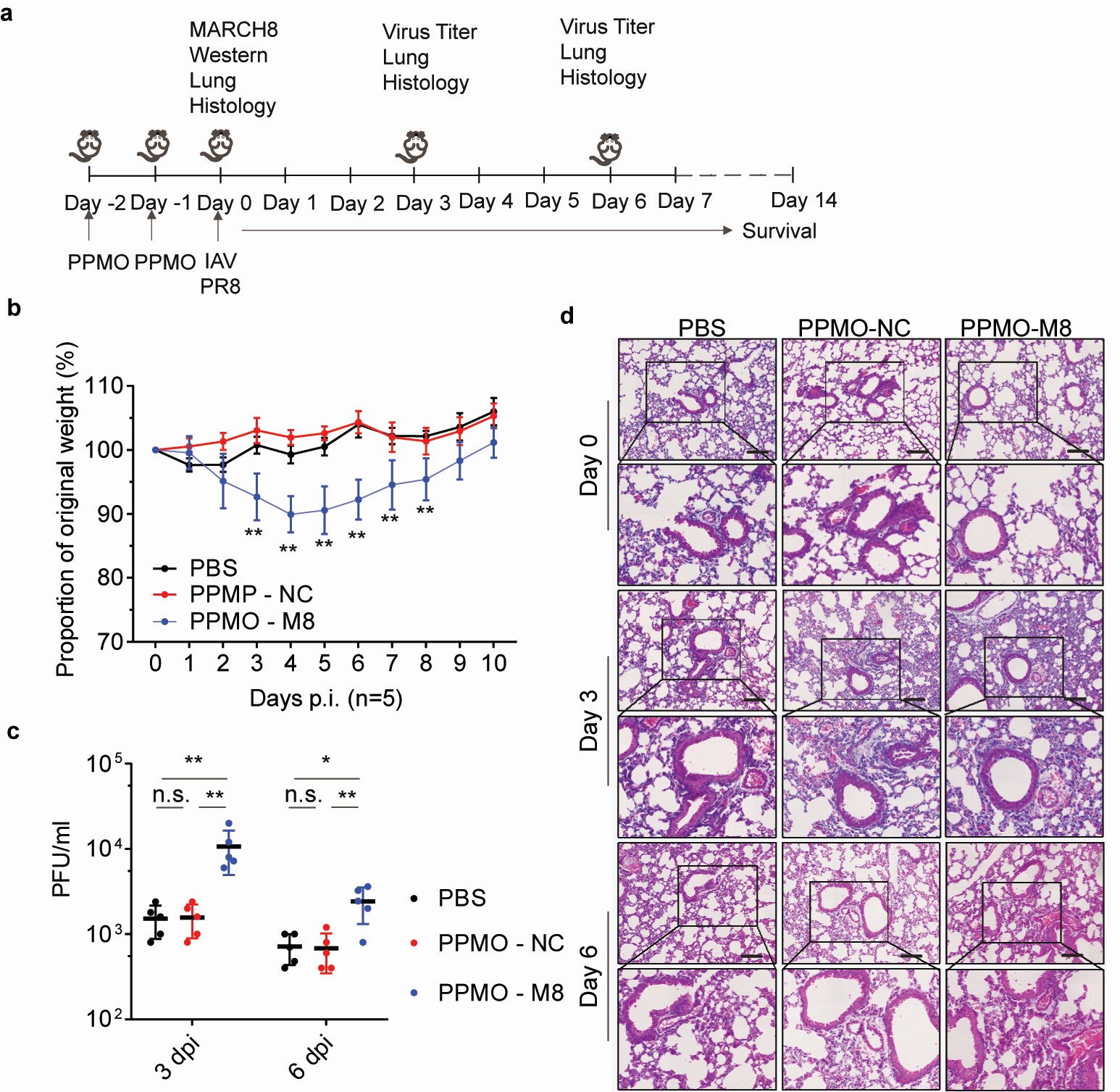
PPMO靶向降低小鼠肺臟中MARCH8蛋白表達后促進甲型流感病毒的復制
供稿|病原生物學研究所