
2022年8月15日,中國(guó)醫(yī)學(xué)科學(xué)院病原生物學(xué)研究所崔勝研究團(tuán)隊(duì)和中國(guó)科學(xué)院生物物理所鄧紅雨團(tuán)隊(duì)在Nature Communications《自然通訊》雜志在線發(fā)表了題為“Structural Basis for Sarbecovirus ORF6 Mediated Blockage of Nucleocytoplasmic Transport”(沙貝病毒輔助蛋白ORF6劫持核孔轉(zhuǎn)運(yùn)的結(jié)構(gòu)基礎(chǔ))的論文。
當(dāng)前,受關(guān)注的SARS-CoV-2變種病毒(VOCs)不斷涌現(xiàn),對(duì)全球經(jīng)濟(jì)和公共衛(wèi)生安全帶來(lái)新一輪挑戰(zhàn)。阿爾法(Alpha)、德爾塔(Delta)、奧密克戎(Omicron)等VOCs不僅在S蛋白上發(fā)生大量突變,突破中和抗體、疫苗的保護(hù)作用,還提高了ORF9b和ORF6等輔助蛋白的mRNA、蛋白質(zhì)的表達(dá)水平,強(qiáng)化了變種病毒抑制天然免疫的能力。
本研究團(tuán)隊(duì)基于前期研究工作,進(jìn)一步解析了SARS-CoV-2和SARS-CoV ORF6 C-末端片段(CTT)與細(xì)胞核孔復(fù)合物組分Rae1-Nup98形成的2個(gè)復(fù)合物晶體結(jié)構(gòu),通過結(jié)構(gòu)分析發(fā)現(xiàn),ORF6與水皰性口炎病毒 (VSV) 基質(zhì)蛋白 M 和皰疹病毒(MHV-68)ORF10的功能類似,它們均結(jié)合在Rae1-Nup98復(fù)合物表面的mRNA溝槽。利用ITC、EMSA等技術(shù),證明了ORF6 CTT與RNA競(jìng)爭(zhēng)結(jié)合Rae1-Nup98的mRNA溝槽,從而妨礙mRNA的核孔運(yùn)輸。最后通過免疫共沉淀實(shí)驗(yàn),核-胞質(zhì)轉(zhuǎn)運(yùn)實(shí)驗(yàn)以及干擾素刺激下的熒光素酶報(bào)告體系等,驗(yàn)證了ORF6介導(dǎo)的mRNA出核、STAT1的入核以及相應(yīng)的天然免疫抑制與ORF6 CTT密切相關(guān),ORF6 CTT與 Rae1-Nup98的親和力與ORF6的功能正相關(guān)。綜合一系列研究結(jié)果提出了ORF6 CTT作為一種新型免疫調(diào)節(jié)劑的潛在應(yīng)用前景。
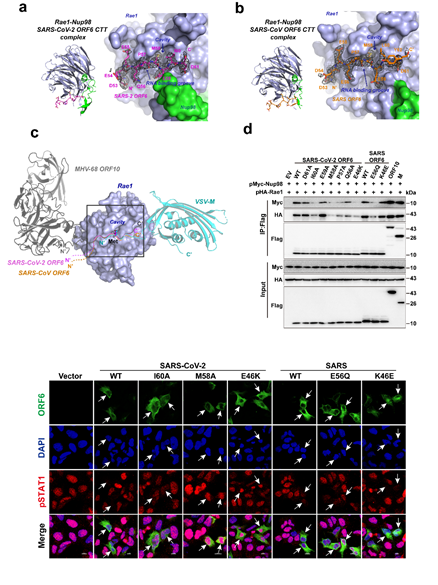
圖. SARS-CoV-2/SARS-CoV ORF6 CTT與核孔復(fù)合物物組分Rae1-Nup98的復(fù)合物晶體結(jié)構(gòu)和功能驗(yàn)證
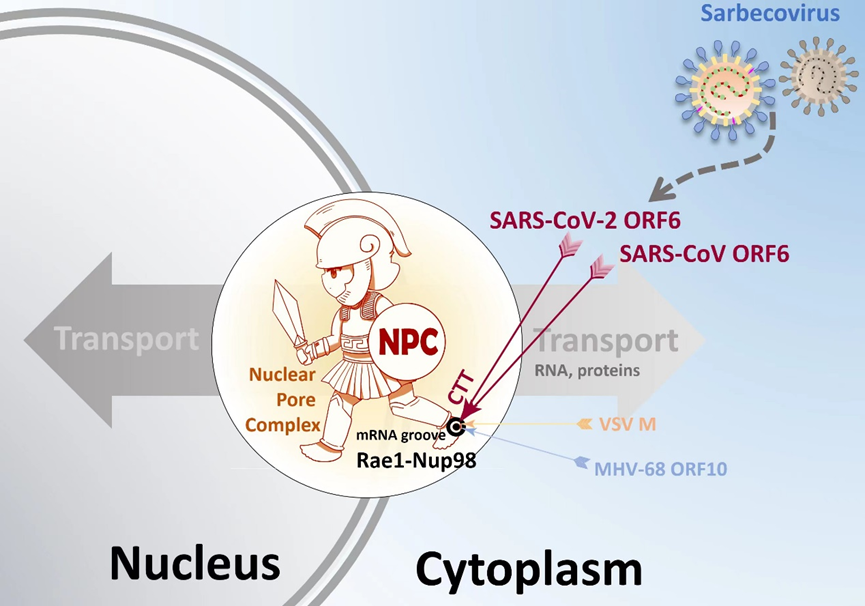
圖. Sarbecovirus輔助蛋白ORF6抑制天然免疫的模式圖
本研究獲得了中國(guó)醫(yī)學(xué)科學(xué)院醫(yī)學(xué)與健康科技創(chuàng)新工程(2021-I2M-1-037)、科技部國(guó)家重點(diǎn)研發(fā)計(jì)劃(2019YFC0840602)、國(guó)家自然科學(xué)基金(81971985;81772207;81572005;81921005)等項(xiàng)目的資助。中國(guó)醫(yī)學(xué)科學(xué)院病原生物學(xué)研究所崔勝研究員和中國(guó)科學(xué)院生物物理所鄧紅雨研究員為本文的共同通訊作者,崔勝課題組副研究員高小攀博士、鄧紅雨課題組助理研究員田華彬博士以及崔勝課題組博士后朱凱翔為本文的共同第一作者。
原文鏈接:https://www.nature.com/articles/s41467-022-32489-5