
2023年10月17日,中國醫(yī)學(xué)科學(xué)院生物醫(yī)學(xué)工程研究所梅林團隊與中山大學(xué)陳洪中團隊、南洋理工大學(xué)趙彥利團隊合作在Nature Communications 《自然通訊》發(fā)表了題為“NIR-dye bridged human serum albumin reassemblies for effective photothermal therapy of tumor”(NIR染料橋接人血清白蛋白自組裝納米粒用于腫瘤的高效光熱治療)的論文。該研究開發(fā)了一種新型人血清白蛋白(HSA)藥物遞送體系,用于高效負載具有雙馬來酰亞胺結(jié)構(gòu)的近紅外(NIR)染料,實現(xiàn)了抗腫瘤藥物的主動靶向遞送和腫瘤的高效光熱治療。
自白蛋白紫杉醇(Abraxane)在臨床成功應(yīng)用以來,基于HSA的藥物遞送系統(tǒng)因其具有優(yōu)異的生物相容性和藥動學(xué)性質(zhì),已被廣泛應(yīng)用于腫瘤靶向藥物遞送。盡管目前已經(jīng)報道了許多基于HSA的藥物遞送系統(tǒng),這些系統(tǒng)仍然存在藥物負載率低(低于10%)、制備工藝復(fù)雜等問題。因此,開發(fā)兼具高藥物負載率和高藥物遞送效率的HSA體系制備技術(shù)仍然具有挑戰(zhàn)性。在本研究中,該團隊報道了一種新型HSA制劑的制備技術(shù),用于負載具有雙馬來酰亞胺結(jié)構(gòu)的NIR染料BPY(本研究合成的具有光熱活性BODIPY類小分子BPY-Mal2,見圖1)。該制備技術(shù)首先通過TCEP[三(2-羧乙基)膦,一種二硫鍵還原劑]將鏈接HSA的二硫鍵剪開,使得HSA失去三級結(jié)構(gòu)變?yōu)殡逆湣?/span>隨后,再利用馬來酰亞胺和巰基的反應(yīng)負載BPY,將BPY橋接在肽鏈之間,通過藥物與肽鏈之間的交聯(lián)形成自組裝納米粒(圖2)。相比于之前報道的HSA藥物遞送體系,該技術(shù)所制備的BPY@HSA顯著提高了藥物負載率(26.1%),并在體外表現(xiàn)出了增強的細胞攝取和3D腫瘤球滲透能力。這是由于改性后的HSA不僅能與gp60結(jié)合,還能與gp18和gp30等受體結(jié)合,這提高了腫瘤細胞對BPY@HSA的主動攝取效率。體內(nèi)研究亦表明該體系具有良好的靶向效率,可作為一種新型光熱治療體系用于光熱消融腫瘤。
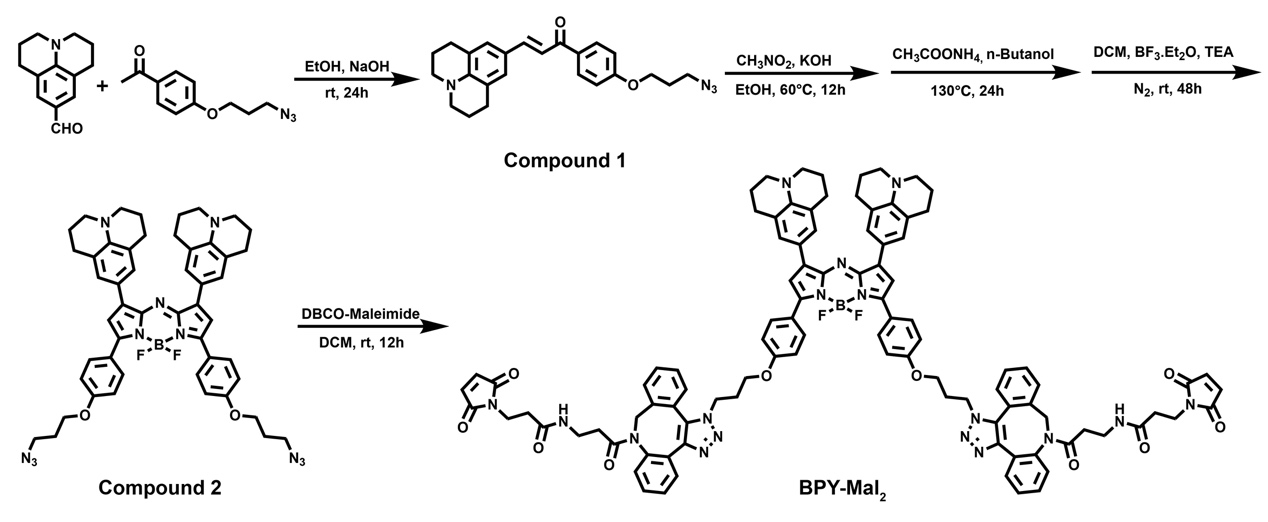
圖1. BPY的合成路線
這項工作開發(fā)的HSA藥物遞送系統(tǒng)的藥物負載模式,有望用于實現(xiàn)更多的具有雙馬來酰亞胺結(jié)構(gòu)藥物的高效負載和靶向遞送,以提高藥物遞送效率,將為癌癥和其它疾病的治療藥物的負載提供重要的策略。
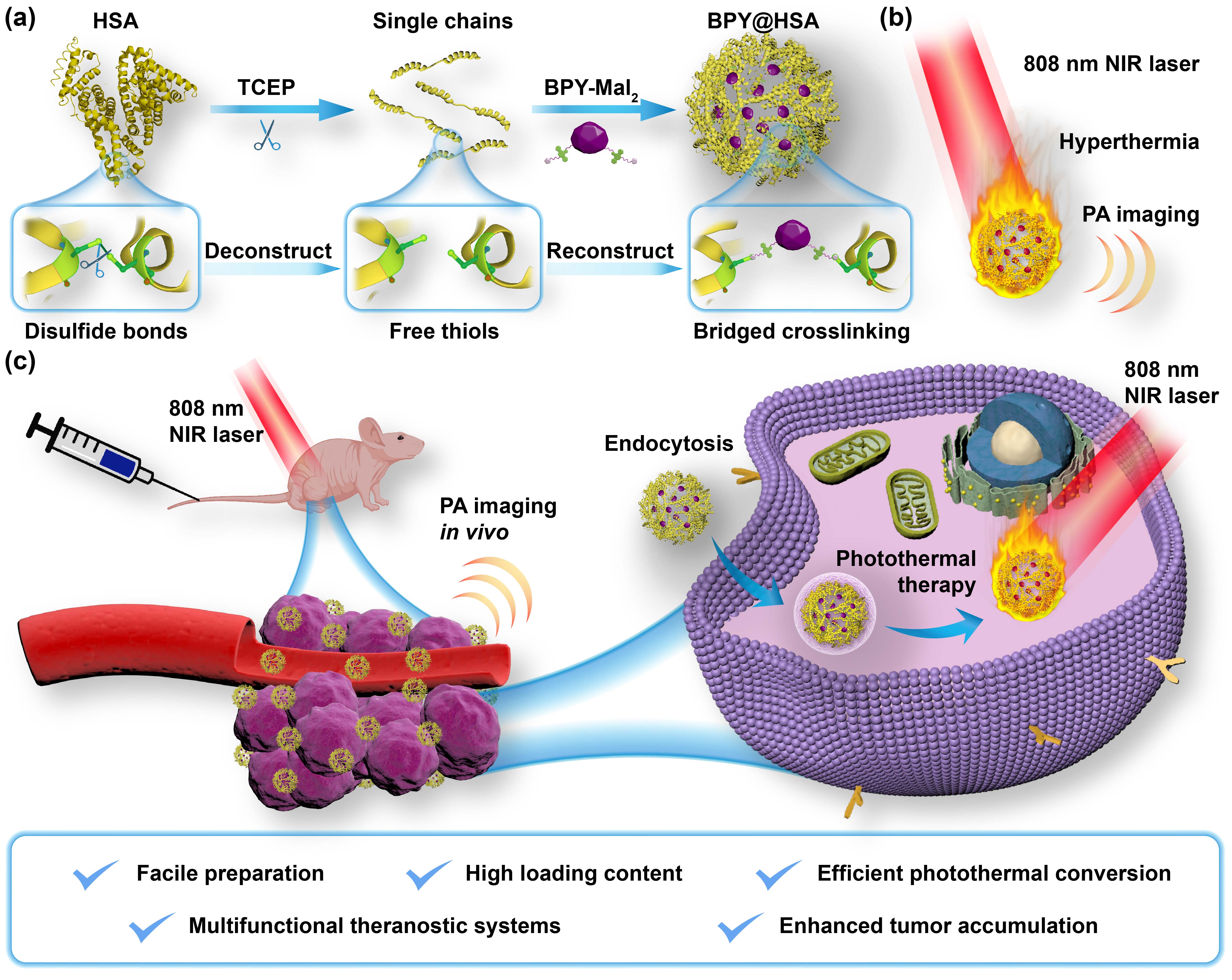
圖2. 開發(fā)BPY@HSA用于腫瘤高效光熱治療
本研究工作以中國醫(yī)學(xué)科學(xué)院生物醫(yī)學(xué)工程研究所為第一作者單位,獲得國家自然科學(xué)基金項目(32101065和82272154)、中央高校基本科研業(yè)務(wù)費(2021-RC310-005)、天津市杰出青年基金(22JCJQJC00120)和中國醫(yī)學(xué)科學(xué)院醫(yī)學(xué)與健康科技創(chuàng)新工程(2021-I2M-1-058、2022-I2M2-003)等項目資助。中國醫(yī)學(xué)科學(xué)院生物醫(yī)學(xué)工程研究所和天津市生物醫(yī)學(xué)材料重點實驗室梅林研究員、新加坡南洋理工大學(xué)趙彥利教授和中山大學(xué)陳洪中副教授為本文章的共同通訊作者,北京協(xié)和醫(yī)學(xué)院在讀博士生史照青、雒苗苗和中山大學(xué)博士生黃啟立為共同第一作者。
論文鏈接:https://www.nature.com/articles/s41467-023-42399-9