
本研究團隊在METTL3的亞細胞定位篩查中發現,不同于大多數情況METTL3與METTL14、WTAP共定位于細胞核(三者組成甲基轉移酶復合體MTase,負責催化m6A修飾的產生),在胃癌、前列腺癌、胰腺癌、白血病中,METTL3特異性富集在腫瘤細胞的細胞質中。并且METTL3在細胞質的富集程度與腫瘤進展密切相關,其中以胃癌最為顯著(圖1)。后續的功能實驗證實,胞質特異性表達在的METTL3確實能夠促進胃癌的發生發展。
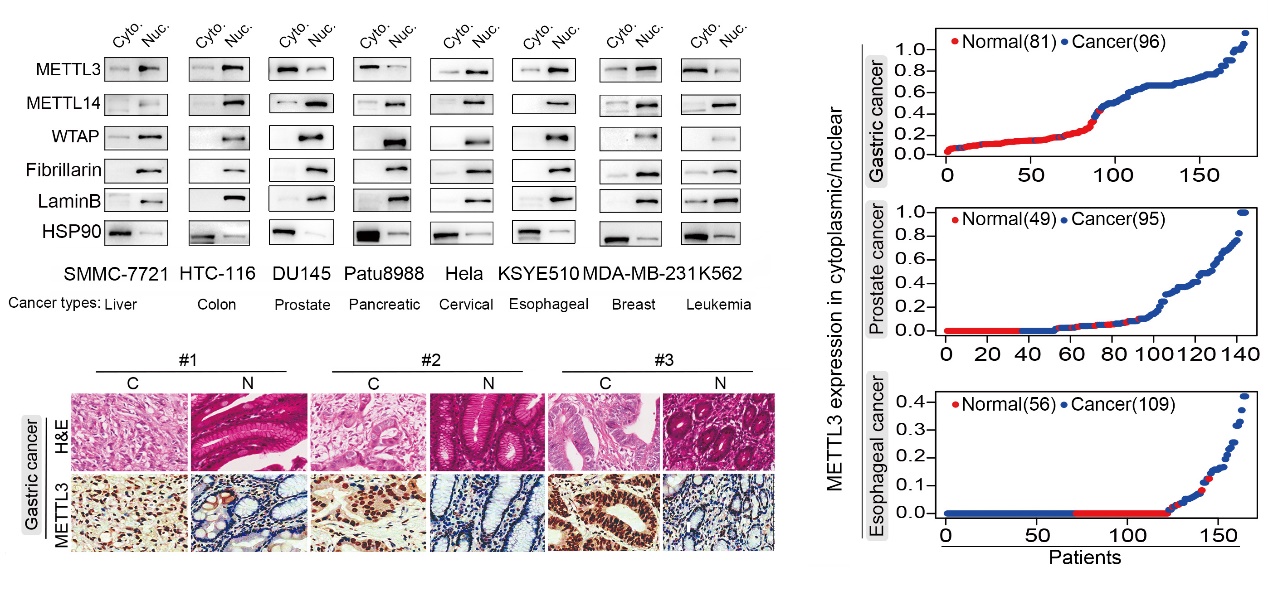
圖1. METTL3在胃癌細胞質中特異性富集
本研究團隊進一步通過MeRIP-seq、CLIP-seq探究METTL3在胃癌細胞質中的致癌新機制。分析和驗證發現,胃癌細胞中METTL3更傾向于結合在非m6A修飾的轉錄本上并增強其翻譯效率,提示其不依賴于m6A修飾的新型功能(圖2)。進而通過質譜分析鑒定出一系列在細胞質中與METTL3互作的蛋白質。與以往報道的在細胞核內作為m6A“書寫器”或細胞質內作為m6A“閱讀器”的身份所不同的是,我們在胃癌中發現,METTL3能夠與細胞質中poly(A)結合蛋白PABPC1相互作用,通過增強PABPC1與帽結合復合物eIF4F結合的穩定性促進mRNA 成環,并最終影響翻譯起始和核糖體再循環過程(圖3)。此外,野生型和甲基化轉移酶活性缺失的METTL3均能通過促進非m6A修飾的表觀遺傳調控因子的的翻譯加速胃癌進展;相反,在胃癌細胞系和患者來源的異種移植瘤模型中抑制METTL3的表達均能延緩胃癌細胞的生長,提示METTL3在胃癌中的潛在治療價值。
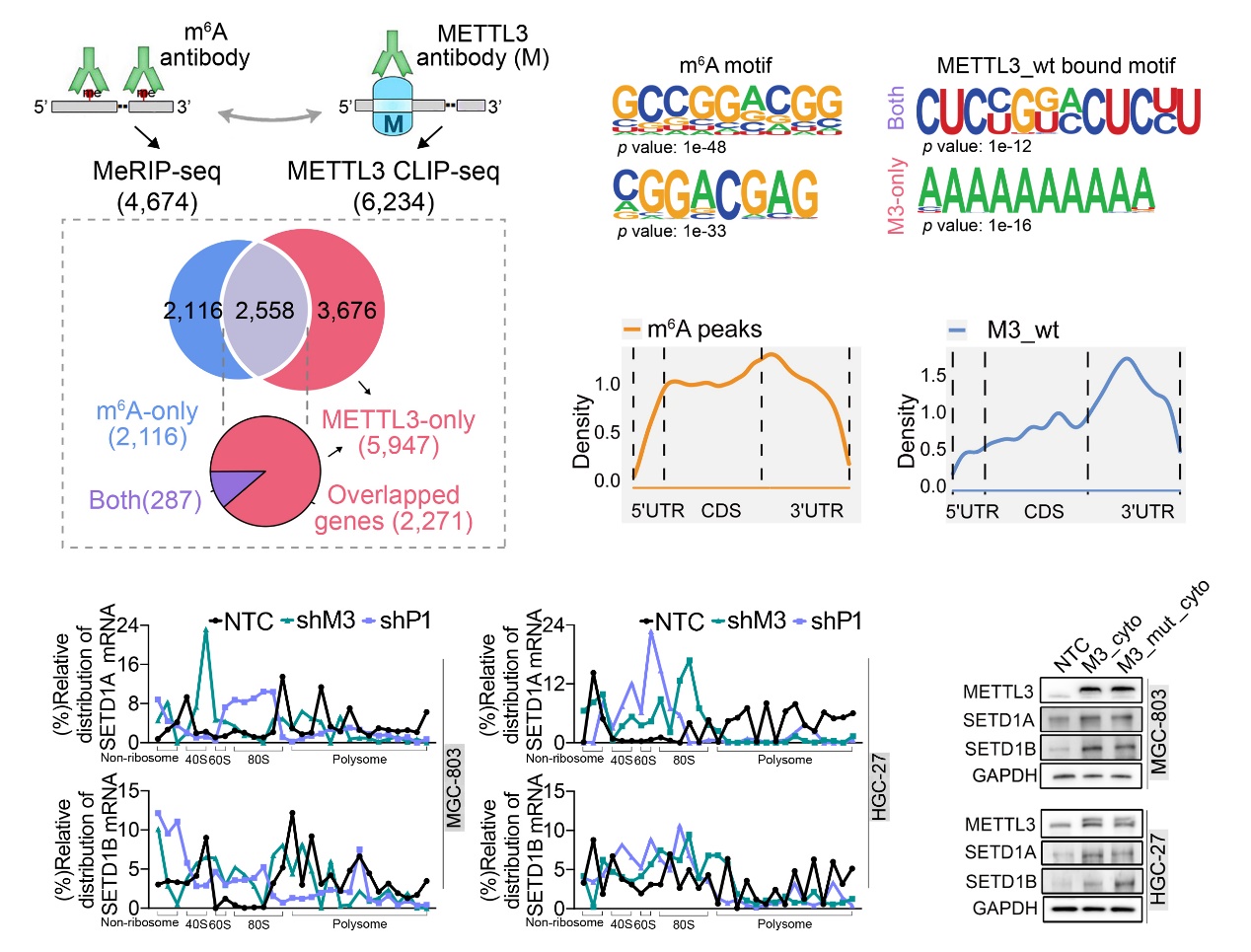
圖2. METTL3傾向結合于非m6A修飾的轉錄本并促進其翻譯
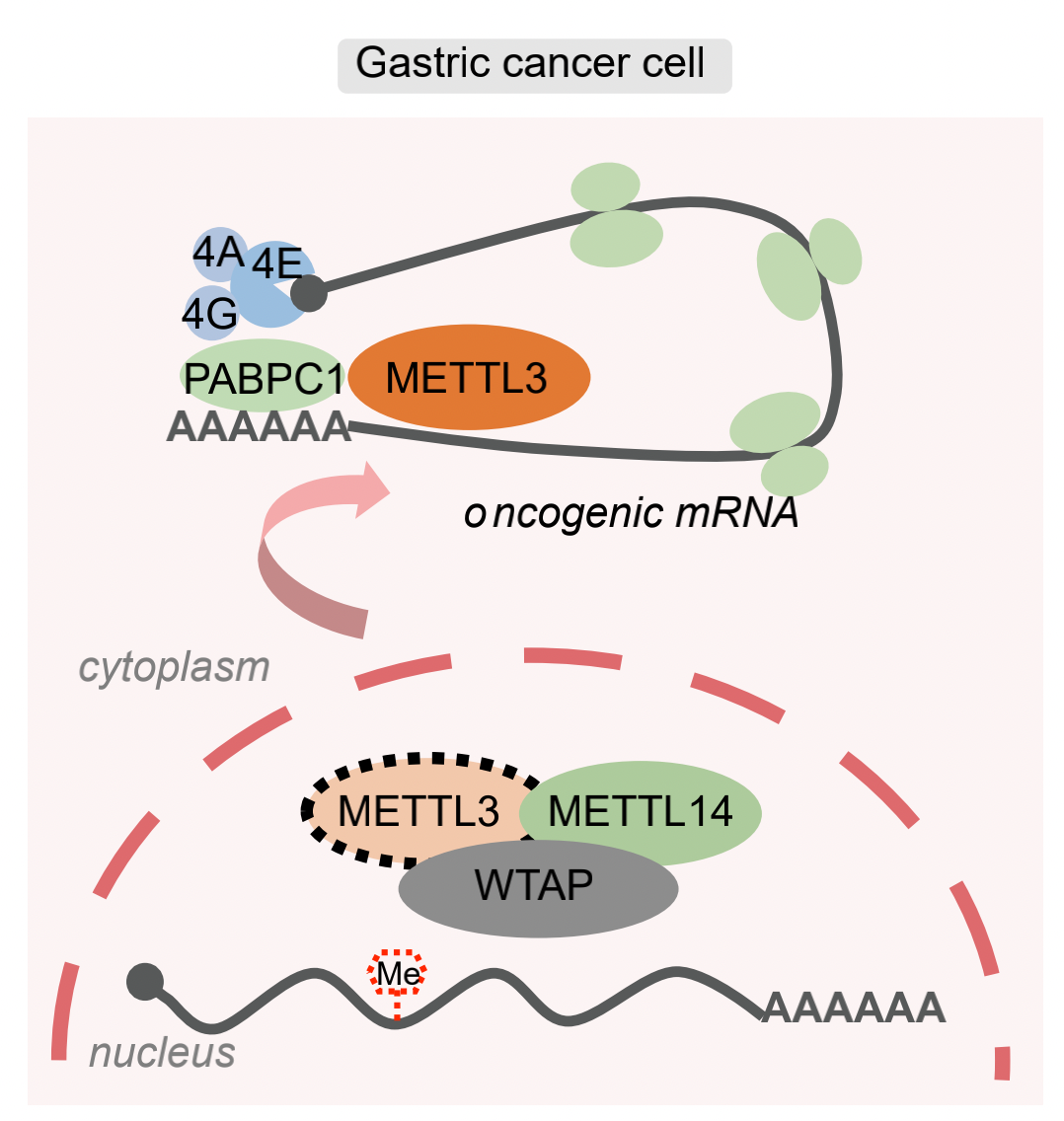
圖3. METTL3通過與PABPC1互作調控關鍵表觀因子的翻譯促進胃癌發生發展
本研究揭示了METTL3不依賴于m6A的新型、非經典調控機制,豐富了對RNA甲基化關鍵分子METTL3的全面認識;更重要的是,我們發現在包括胃癌在內的多種腫瘤中,細胞質中的METTL3豐度與患者生存期密切相關。因此,在這些腫瘤中,抑制METTL3或METTL3-PABPC1互作代表了比靶向其甲基轉移酶活性更有前途的治療方法。
本研究工作得到中國醫學科學院醫學與健康科技創新工程(2021-I2M-1-019;2021-I2M-1-040)等項目的資助。基礎醫學研究所余佳教授和王芳教授、藥物研究所金晶教授、重慶腫瘤醫院的鄒冬玲教授為論文共同通訊作者,基礎醫學研究所魏雪菊、霍悅博士、皮靜楠博士、高玉風博士、何漫漫博士、南方醫科大學饒栓教授為論文的共同第一作者。
論文鏈接:https://www.nature.com/articles/s41556-022-00968-y